Mes paaiškiname, kas yra atomas ir kaip sudaryta kiekviena jo dalis. Taip pat jos istorija, tyrimai apie tai ir kas yra molekulė.

Kas yra atomas?
Mažiausias vienetas, kuris sudaro reikalas.
Žodis atomas kilęs iš senovės graikų (atomas, „Be padalijimo“) ir buvo sukurtas pirmųjų filosofų, kurie iškėlė teoriją apie daiktų sudėtį, tai yra elementariąsias daleles. visata. Nuo tada, atsiradus atominiai modeliai, jų įsivaizdavimo būdas labai skyrėsi, nes atominis modelis per šimtmečius pakeitė ankstesnįjį, kol pasiekėme tą, kurį naudojame šiandien.
Atomai turi savybių cheminis elementas kurie sudaro ir, savo ruožtu, elementai yra organizuojami ir klasifikuojami pagal jų atominiai skaičiai, elektroninė konfigūracija ir cheminės savybės Periodinė elementų lentelė elementų.
Tas pats cheminis elementas gali būti sudarytas iš skirtingų tos pačios klasės atomų, ty turinčių tą patį atominį skaičių (skaičius protonų kurių kiekvienas atomas turi elemente), nors jų atominės masės skiriasi.
Pavyzdžiui, yra skirtingų to paties elemento atomų, kurie skiriasi savo skaičiumi neutronų, ir jie vadinami izotopais, reprezentatyvus atvejis yra elemento anglies izotopai (12C, 13C, 14C). Taigi, kiekvienas atomas priklauso tam pačiam cheminiam elementui ar ne, priklausomai nuo jo protonų skaičiaus, taigi atomai, turintys tokį patį protonų skaičių, priklauso tam pačiam cheminiam elementui.
Kaip sudarytas atomas?
Atomai sudaryti iš branduolio ir vieno ar daugiau elektronų (kurie turi neigiamą krūvį) aplink jį. Branduolys sudarytas iš dalelių, vadinamų protonais ir neutronais. Protonai yra teigiamai įkrauti, o neutronai yra neutralūs. Protonų ir neutronų rinkinys vadinamas nukleonais.
Protonus ir elektronus vienas prie kito traukia elektromagnetinė jėga (įkrautų dalelių sąveika su elektriniais ir magnetiniais laukais), o protonus ir neutronus vienas prie kito traukia branduolinė jėga (jėga, kurią patiria tik dalelės, sudarančios atomo branduolys).
Kaip susijungia atomai?
Atomai gali susijungti vienas su kitu, kad susidarytų cheminiai ryšiai, kas nutinka, kai jie vienaip ar kitaip dalijasi savo elektronais. Cheminiai ryšiai gali būti kovalentinis, joninės Y metalinis, iš kurio susidaro kovalentiniai molekuliniai junginiai, joniniai tinklai arba metaliniai junginiai (nors svarbu paaiškinti, kad jokia cheminė jungtis nėra absoliučiai kovalentinė ar joninė). Tokiu būdu atomai gali susijungti ir susidaryti molekules paprastas kaip Vanduo, taip pat formuoti makromolekulių sudėtingas kaip baltymas, DNR Y RNR.
Nors atomai skiriasi vienas nuo kito dėl savo dalelių konfigūracijos, tiesa, kad visi to paties elemento atomai yra visiškai identiški: vandenilio atomai Saulė Jie yra tokie patys kaip tie, kurie sudaro mūsų kūną, o anglies atomai šuns kūne yra identiški tiems, kurie sudaro deimantą. Skirtumas yra tai, kaip atomai susijungia ir sudaro skirtingus cheminius junginius, sudarančius organus ir organų sistemas gyvos būtybės, medžiagos, pagamintos industrija, ir visa materija, kuri sudaro visatą.
Atomo dalys
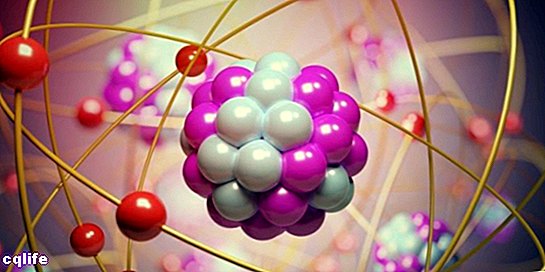
Atomai sudaryti iš dviejų esminių dalių:
- Branduolys. Apie 99,94% atomo masės yra sutelkta branduolyje, kur protonai ir neutronai (kurie kartu vadinami "nukleonais") yra sujungti stipriomis branduolinėmis jėgomis, kurios neleidžia protonams atstumti vienas kitą, turinčius vienodą elektros energiją. mokestis.
- Atominės orbitos. Orbitalė apibūdina erdvės sritį, supančią atomo branduolį, kurioje tikimybė rasti elektroną yra labai aukštas. Šie regionai turi skirtingas formas, kurios gaunamos sprendžiant stacionarią Schrödingerio lygtį. Erwinas Schrödingeris buvo austrų mokslininkas, 1925 m. sukūręs šią lygtį subatominės dalelės, pavyzdžiui, elektronų, raidai apskaičiuoti. Taigi, elektronai aplink branduolį sudaro savotišką „debesį“, kurį vaizduoja atominių orbitų forma. Kita vertus, kiekviena atominė orbita atitinka tam tikrą elektronų energetinę vertę, todėl jie yra suskirstyti pagal savo energetines vertes. Toliau pateiktame paveikslėlyje parodytos pirmųjų atominių orbitų formos:

Atomo istorija

Pirmasis atomų egzistavimo idėją suformulavo graikų filosofas Demokritas (s.V-VI pr. Kr.) iš grynai išgalvotų spėliojimų (kaip tuo metu buvo suprantamas mokslas).
Jo studijų ėmėsi vėlesni filosofai, tokie kaip Leukipas ir Epikūras, tačiau per viduramžių, užgožtas kreacionistinio pasaulio paaiškinimo, kuris viską priskyrė Dievui.
Teko laukti iki 1773 m., kai prancūzų chemikas Antoine'as de Lavoisier postulavo savo teoriją apie materijos nesukūrimą arba sunaikinimą (ji tik transformuojasi) arba Masės tvermės dėsnisleido Johnui Daltonui 1804 m. suformuluoti pirmąją modernią atomo teoriją.
Vienas po kito einantys mokslininkai fizinis ir chemija jie buvo įkvėpti jo darbo pasiūlyti geresnes ir sudėtingesnes sistemas, skirtas suprasti pagrindines materijos daleles. Vėliau buvo pasiūlyti nauji atominiai modeliai iki šiandien dažniausiai naudojamų.
Šiuolaikinė priimta struktūra yra kilusi iš eksperimentai Rutherfordo 1911 m., kartu su Nielso Bohro, Schrödingerio ir Heisenbergo formuluotėmis.
Molekulė
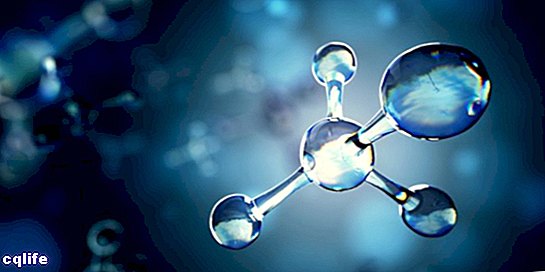
Molekulė žinoma kaip dviejų ar daugiau atomų susijungimas per cheminius ryšius, kad susidarytų sudėtingesnė ir elektriškai neutralesnė struktūra. Cheminės jungtys gali būti kovalentinės arba joninės.
Molekulės gali būti sudarytos iš to paties cheminio elemento atomų, pavyzdžiui, deguonies molekulės (O2), arba iš skirtingų cheminių elementų atomų, pavyzdžiui, iš gliukozės molekulės. Monatominės dujos, pavyzdžiui, helis (He), taip pat laikomos molekulėmis.

